Teorik fiziğin tarihi, delilik ile dahilik arasında gidip gelen eksantrik kişiliklere sahip ilginç karakterlerle doludur. Bu kişilerden birisi de Avusturyalı teorik fizikçi Wolfgang Pauli’dir.
1920’ler, evreni anlayışımızda bir devrime sahne oldu. Bu, Avrupa’nın çeşitli bölgelerinden genç ve parlak bir neslin yeni kuantum mekaniği teorisini keşfettiği, bilim tarihinde büyüleyici bir dönemdi. Bu kişilerin isimleri, geliştirdikleri fikirler ve teorilerle aynıdır.
Örneğin Niels Bohr (Bohr Atom Modeli), Wemer Heisenberg (Heisenberg Belirsizlik İlkesi), Erwin Schrödinger (Schrödinger Denklemi), Enrico Fermi (fermiyonlar) ile ölümsüzleşmiştir. Bu kişilerden birisi de zamanın en zeki bilim insanlarından olarak tanınan Wolfgang Pauli’dir. Günümüzde onun adını da Pauli dışlama ilkesi ile anımsıyoruz.

Pauli, 1921’de 21 yaşındayken görelilik ile ilgili yazdığı ve Einstein’a bile teorisi hakkında birkaç şey öğreten kitabıyla bilim dünyasına bomba gibi düşmüştü. Dobralığıyla -ya da küstah ve kibirli olmasıyla (fizikçiler bu konuda ikiye ayrılmışlardı)- ünlü Pauli, bir derste ayağa kalkarak kim olduğuna ve itibarına bakmaksızın dersi anlatan kişiye tamamen saçmaladığını söylemekten çekinmeyecek kadar da pervasızdı. Bu nedenle de etrafında keskin dilli fizikçi olarak tanınmaya başlanmıştı.

Wolfgang Pauli, abartılı egosuna rağmen yirminci yüzyıl fiziğinin en büyük isimlerindendi. Temel gerçeklik anlayışımıza yaptığı birçok katkının yanı sıra, 1930’da nötrinonun varlığını öngördü. Ancak onun en önemli katkısı ve 1945 yılında Nobel Fizik Ödülü’nü almasını sağlayan şey adı ile anılan dışlama ilkesi olacaktı.
Pauli Dışlama İlkesi Nedir?
Herhangi bir nesnenin neden yapıldığını araştırmak isterseniz, onu giderek daha küçük parçalara ayırabilirsiniz. Sonucunda tüm canlılar hücrelerden, hücreler de atomlardan oluşur. Atomların kendileri de atom çekirdeğine ve elektronlara parçalanabilir. Son olarak, atom çekirdeklerini de kendilerini oluşturan temel parçacıklara ayırmak olasıdır. Peki bu bileşen parçacıkları nasıl oluyor da gördüğümüz, bildiğimiz ve etkileşime girdiğimiz her şeyi oluşturuyor? Bu soruya cevap Wolfgang Pauli tarafından verilecekti.

Çoğumuz kuantum mekaniğini düşündüğümüzde, en küçük ölçeklerdeki tuhaf ve mantık dışı şeyleri düşünürüz. Heisenberg belirsizliği ya da Schrödinger’in kedisini aklımıza getiririz. Ancak, iki özdeş fermiyonun aynı sistemde aynı tam kuantum durumunu işgal edemeyeceğini belirten Pauli dışlama ilkesini pek bilmeyiz.
Pauli dışlama ilkesi, kuantum mekaniğinde, bir atomun yörüngelerinden herhangi birini neden yalnızca sınırlı sayıda elektronun işgal edebildiğini açıklayan bir kuraldır. Hiçbir özdeş parçacık çifti aynı anda aynı kuantum durumunu işgal edemez. Bu prensip kuantum teorisinde temel bir rol oynar ve fermiyonlar (örn. elektronlar, protonlar ve nötronlar) için geçerlidir ancak bozonlar (örn. fotonlar) için geçerli değildir.
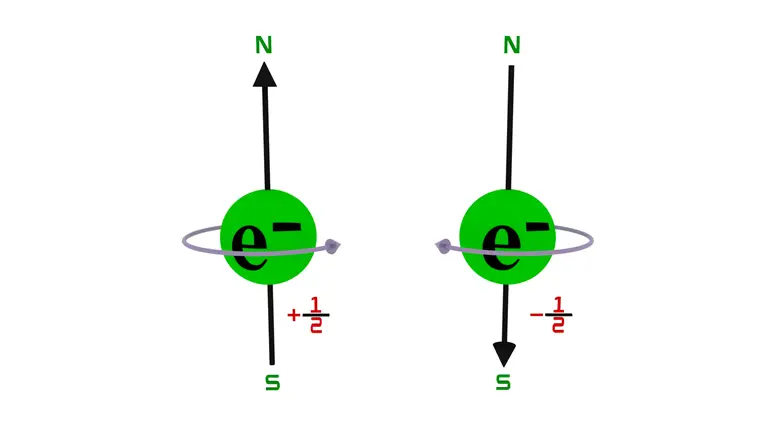
Pauli Dışlama İlkesinin sonuçlarından biri, eğer iki elektron bir atomda ya da molekülde çift oluşturmuşsa ve aynı enerjiye sahipse o zaman bu iki elektronun spininin birbirine zıt olması gerektiğidir.
Pauli Dışlama İlkesi Neden Önemlidir?
Aynı orbitalde iki elektrondan fazlasına müsaade etmeyen Pauli dışlama ilkesi, atomların birbirlerinden farklı olmasının nedenidir. Bu ilke olmasaydı, bir atomun temel (en düşük enerji) durumunu doldurabilecek elektron sayısında bir sınır olmayacaktı. Sonucunda bu durumda, en düşük enerji yörüngesi — her atomdaki 1s yörüngesi — elektronları içeren tek yörünge olacaktı ve her atomun doğasında bulunan elektronların tümünü içerecekti.

Pauli Dışlama İlkesi, tüm elektronların aynı en düşük enerji (temel) durumuna düşmesini engeller. Bize birden fazla özdeş fermiyonu aynı kuantum durumuna koyamayacağımızı söyler.
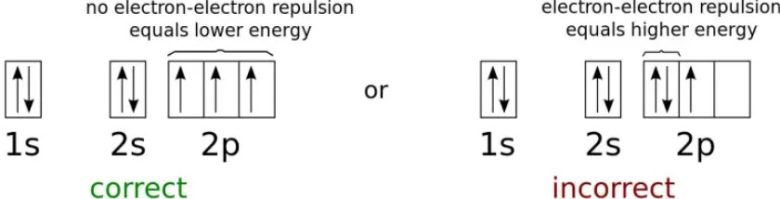
Pauli dışlama ilkesi her bir atoma kendi benzersiz yapısını veren şeydir. Atomlarımıza daha fazla sayıda elektron ekledikçe, hepsine bir yer bulmak için daha yüksek enerji seviyelerine, daha büyük açısal momentumlara ve giderek daha karmaşık yörüngelere sahip olmamız gerekir. Bu sayede de periyodik tablodaki her bir atom, diğerlerinden farklı bir elektron konfigürasyonuna sahip olur.
Bir elementin fiziksel ve kimyasal özelliklerini belirleyen en dış kabuklardaki elektronların özellikleri olduğundan, her bir atomun oluşturabildiği kendine özgü atomik, iyonik ve moleküler bağ kümeleri vardır. Bu nedenle de birbirine ne kadar benzerse benzesin iki farklı elementten oluşan yapılar aynı olamaz.
Sonuç olarak
Pauli Dışlama İlkesine sahip olmasaydık, Evrenimiz son derece farklı olurdu. Bu durumda her atom hidrojenle hemen hemen aynı özelliklere sahip olurdu. Bunun sonucu olarak da yaşamın yapı taşları olan karbon bazlı organik bileşiklerin ortaya çıkması imkansız olurdu. Richard Feynman’ın dediği gibi, “Masaları ve katı olan diğer her şeyi mümkün kılan, elektronların hepsinin üst üste gelememesidir. “
Kaynaklar ve ileri okumalar
- Wolfgang Pauli’s quantum rule makes existence possible. Yayınlanma tarihi: Kaynak site: Bağlantı: Wolfgang Pauli’s quantum rule makes existence possible
- The “sharp-tongued” physicist who everyone was scared of. Yayınlanma tarihi: 10 Şubat 2022. Kaynak site: Real Clear Science.The “sharp-tongued” physicist who everyone was scared of
- Bonolis, Luisa. (2013). International Scientific Cooperation During the 1930s. Bruno Rossi and the Development of the Status of Cosmic Rays into a. Branch of Physics. Annals of Science. 71. 10.1080/00033790.2013.827074.
Size Bir Mesajımız Var!
Matematiksel, 2015 yılından beri yayında olan ve Türkiye’de matematiğe karşı duyulan önyargıyı azaltmak ve ilgiyi arttırmak amacıyla kurulmuş bir platformdur. Sitemizde, öncelikli olarak matematik ile ilgili yazılar yer almaktadır. Ancak bilimin bütünsel yapısı itibari ile diğer bilim dalları ile ilgili konular da ilerleyen yıllarda sitemize dahil edilmiştir. Bu sitenin tek kazancı sizlere göstermek zorunda kaldığımız reklamlardır. Yüksek okunurluk düzeyine sahip bir web sitesi barındırmak ne yazık ki günümüzde oldukça masraflıdır. Bu konuda bizi anlayacağınızı umuyoruz. Ayrıca yazımızı paylaşarak veya Patreon üzerinden ufak bir bağış yaparak da büyümemize destek olabilirsiniz. Matematik ile kalalım, bilim ile kalalım.
Matematiksel






